Homo Sapiens, L’incapacità di biosintesi dell’acido ascorbico e la sintesi chimica
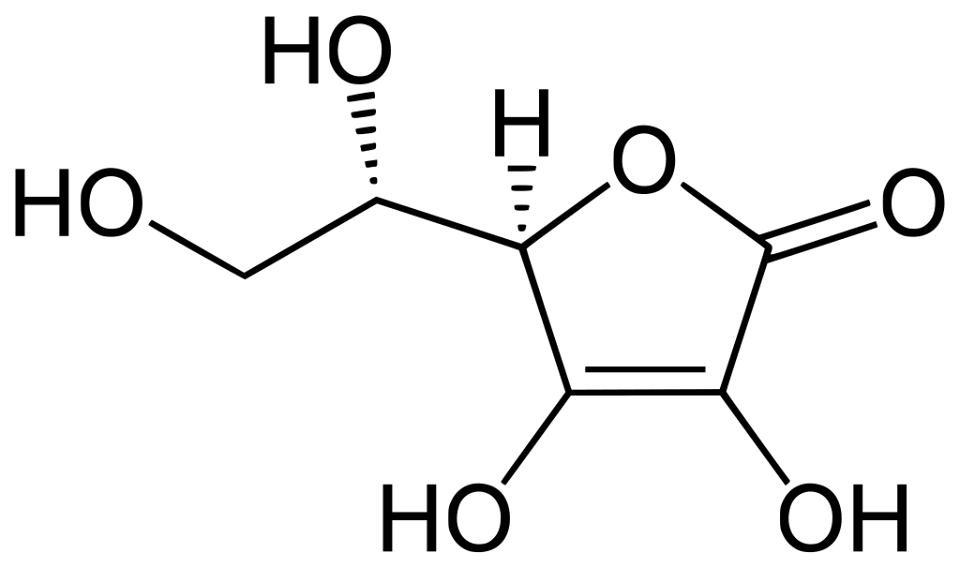
Figura 1 – Struttura dell’acido L-Ascorbico – By Yikrazuul – Own work, Public Domain, https://commons.wikimedia.org/w/index.php?curid=5886009
Molti organismi viventi da esseri monocellulari come funghi a sistemi viventi più complessi sono in grado di sintetizzare acido ascorbico [Figura1] come piante, mammiferi, uccelli ecc. L’enzima finale, in questa complessa sintesi è L-gulono-γ-lattono ossidasi [EC: 1.1.3.8] negli animali [Figura 2][1] e L-galattono-1,4 lattone deidrogenasi

Figura 2 – Le fasi finali della biosintesi dell’acido ascorbico ( 3b ) dall’acido gulonico: l’acido L-gulonico ( 1 ) viene convertito in L-gulonolattone (L-gulono-1,4-lattone) ( 2 ) sotto l’influenza catalitica di un glucono-lattonasi ( A ) . Nell’ultima fase, L-gulonolactone ossidasi ( B ) catalizza l’ossidazione selettiva di L-gulonolactone a 2-cheto-L-gulone lattone ( 3a ), che spontaneamente tautomerizza in acido ascorbico ( 3b ) . Il perossido di idrogeno (H 2 O 2 ) viene prodotto come sottoprodotto dell’ossidazione – Von Yikrazuul – Eigenes Werk, Gemeinfrei, https://commons.wikimedia.org/w/index.php?curid=6238581
[EC: 1.3.2.3] nelle piante [2]. Le due vie metaboliche possono essere osservate in kegg [1]. L’acido ascorbico è un metabolita essenziale per la vita di moltissimi sistemi viventi e dove non sia possibile sintetizzarlo come nei primati è opportuno assumerlo con la dieta. Negli animali l’enzima chiave per la biosintesi di acido L-ascorbico è L-gulono-γ-lattono ossidasi [EC: 1.1.3.8], sembra che in lontano passato il gene deputato alla produzione di questo enzima sia stato funzionale e che una mutazione o serie di mutazioni abbia portato il gene a non essere più in grado di sintetizzarlo. La biosintesi dell’acido ascorbico ha origini antichissime, sembra ancor prima che le filogenesi di piante e animali divergessero. Quando i sistemi viventi hanno portato ai primati, si sarebbero verificate una serie di mutazioni in grado di disattivare la produzione di L-gulono-γ-lattono ossidasi [EC: 1.1.3.8] con conseguente annullamento biosintesi di acido ascorbico, assimilabile esclusivamente con la dieta []. Condizioni simili ai primati sono verificabili in molti mammiferi come i ratti. I ratti wistar sono stati oggetto di studio genetico e gli scienziati giapponesi Kawai e collaboratori dimostrarono mutazione a base singola da G a A sul nucleotide 182, e conseguente alterazione dell’enzima [EC: 1.1.3.8] con sostituzione aminoacido residuo di amminoacido Cisteina a Tirosina [4]. I globuli rossi nei primati sono in grado di trasportare la forma intermedia deidroascorbico così da ottimizzare l’utilizzo ai massimi livelli possibile [5-6]. Il fabbisogno dell’acido L-ascorbico è molto elevato sia come conservante, integratore alimentare e farmaco a dosi elevate. Esso viene estratto dalla biosintesi naturale in molte specie vegetali come rosa canina o ciliegia acerola etc, ma la fonte principale è la sintesi con il metodo Reichstein [7-11]. Questa metodologia sintetica viene condotta con una serie di step intermedi [Figura 3]:
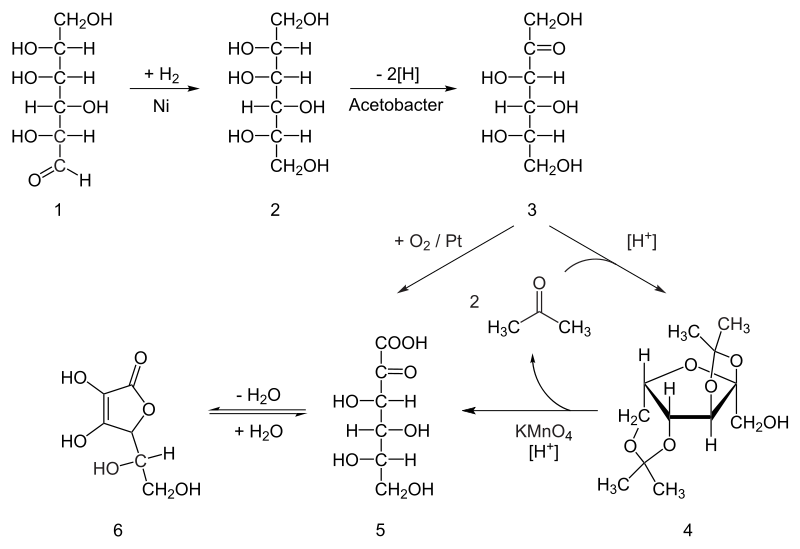
Figura 3 – La sintesi industriale storica, dell’acido ascorbico partendo dal glucosio attraverso il processo di Reichstein .By Yikrazuul – Own work, Public Domain, https://commons.wikimedia.org/w/index.php?curid=4951563
1-2) idrogenazione catalitica con nichel del glucosio per ottenere sorbitolo a elevate temperatura e pressione;
2-3) ossidazione del sorbitolo con acebacter suboxydans a pH 4-6 e T= 30°C a L-sorbosio;
3-4) protezione di 4 gruppi ossidrili del L-sorbosio con acetone e formazione di acetali;
3-5) l’ossidazione con ossigeno catalizzata da platino su L-sorbosio conduce a acido 2-cheto L-gulonico;
4-5) la forma acetalica ottenuta trattando L-sorbitolo con acetone può essere condotta alternativamente
a acido diprogulico prima e per successivo riscaldamento a acido 2-cheto L-gulonico utilizzando
come ossidante il permanganato di potassio in ambiente acido;
5-6) la lattonizzazione γ dell’acido 2-cheto L-gulonico.
L’acido ascorbico è strutturalmente un acido vinilico e per perdita di un protone forma l’anione ascorbato e si stabilizza per risonanza [Figura 4].
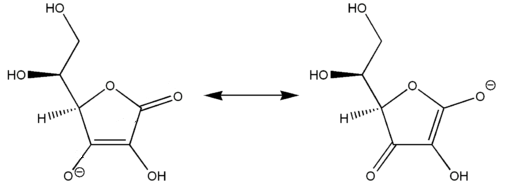
Figura 4 – Forme canoniche in risonanza dell’anione ascorbato che lo rendono relativamente stabile – By User: Petergans, CC BY-SA 3.0, https://commons.wikimedia.org/w/index.php?curid=28932753;
L’attacco del doppio legame sul protone la formazione di un derivato 1-3 dichetonico [Figura 5].
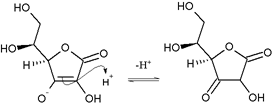
Figura 5 – Addotto 1-3 dichetonico – CC BY-SA 3.0, https://commons.wikimedia.org/w/index.php?curid=579617
L’acido ascorbico è un potente antiossidante e spesso pro-ossidante a secondo delle condizioni termodinamiche e fisiologiche. Esso è in grado di rigenerare il glutatione ossidato [12-14], contribuisce alla rigenerazione del tocoferolo, reagendo con la forma radicalica [15-16], e tutta una serie di altre circostanze riportate nel mio precedente manoscritto [17].
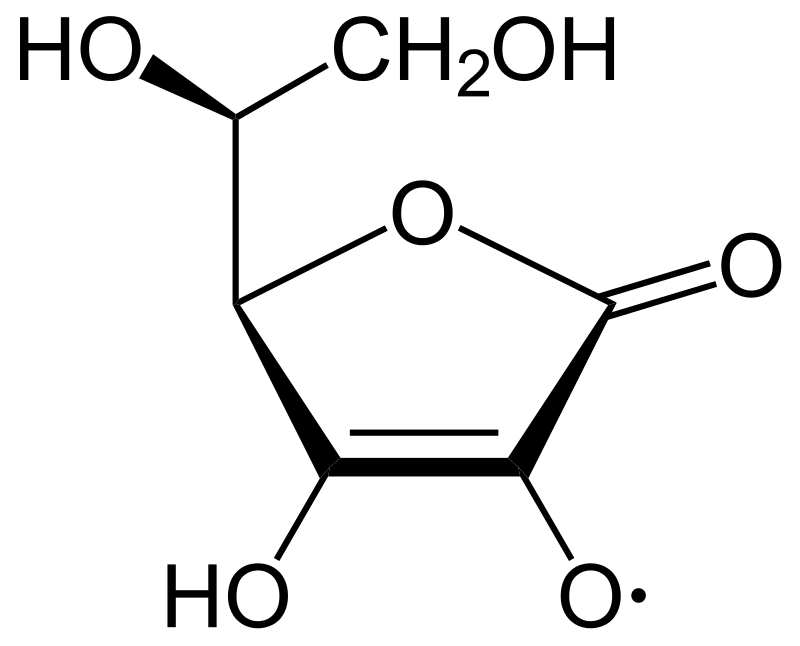
Figura 6 -Radicale semiidroascorbico – By NEUROtiker – Own work, Public Domain, https://commons.wikimedia.org/w/index.php?curid=2332468

Figura 7 – Acido deidroascorbico – By Stanislaw Gackowski – Own work, Public Domain, https://commons.wikimedia.org/w/index.php?curid=8808961
Homo Sapiens, The inability to ascorbic acid biosynthesis and chemical synthesis
Many living organisms from single-celled beings such as fungi to more complex living systems are able to synthesize ascorbic acid [Figure1] such as plants, mammals, birds etc. The final enzyme in this complex synthesis is L-gulono-γ-lactone oxidase [EC: 1.1.3.8] in animals [Figure 2] [1] and L-galactono-1,4 lactone dehydrogenase [EC: 1.3.2.3] in plants [2]. The two metabolic pathways can be observed in kegg [1]. Ascorbic acid is an essential metabolite for the life of many living systems and where it is not possible to synthesize it as in primates it is appropriate to take it with the diet. In animals, the key enzyme for the biosynthesis of L-ascorbic acid is L-gulono-γ-lactone oxidase [EC: 1.1.3.8], it seems that in the past the gene responsible for the production of this enzyme was functional and that a mutation or series of mutations led the gene to no longer be able to synthesize it. The biosynthesis of ascorbic acid has very ancient origins, it seems even before the phylogenies of plants and animals diverged. When living systems led to primates, a series of mutations would occur that could disable the production of L-gulono-γ-lactone oxidase [EC: 1.1.3.8] with consequent cancellation of ascorbic acid biosynthesis, assimilable only with the diet []. Primate-like conditions can occur in many mammals such as rats. Wistar rats were subjected to genetic study and Japanese scientists Kawai and collaborators demonstrated single-base mutation from G to A on nucleotide 182, and subsequent alteration of the enzyme [EC: 1.1.3.8] with replacement amino acid residue of amino acid Cysteine a Tyrosine [4]. Red blood cells in primates are able to transport the intermediate dehydroascorbic form so as to optimize use at the highest possible levels [5-6]. The requirement for L-ascorbic acid is very high both as a preservative, food supplement and drug at high doses. It is extracted from natural biosynthesis in many plant species such as dog rose or acerola cherry etc, but the main source is the synthesis with the Reichstein method [7-11]. This synthetic methodology is carried out with a series of intermediate steps [Figure 3]:
1-2) nickel catalytic hydrogenation of glucose to obtain sorbitol at high temperature and pressure;
2-3) oxidation of sorbitol with acebacter suboxydans at pH 4-6 and T = 30 ° C at L-sorbose;
3-4) protection of 4 hydroxyl groups of L-sorbose with acetone and formation of acetals;
3-5) oxidation with oxygen catalyzed by platinum on L-sorbose leads to 2-keto L-gulonic acid;
4-5) the acetal form obtained by treating L-sorbitol with acetone can be carried out alternately
diprogulic acid before and subsequent heating with 2-keto L-gulonic acid using
as oxidant potassium permanganate in an acid medium;
5-6) the lactonization γ of 2-keto L-gulonic acid.
Ascorbic acid is structurally a vinyl acid and by loss of a proton it forms the ascorbate anion and stabilizes by resonance [Figure 4]. The attack of the double bond on the proton the formation of a diketone derivative 1-3 [Figure 5]. Ascorbic acid is a powerful antioxidant and often pro-oxidant depending on the thermodynamic and physiological conditions. It is capable of regenerating oxidized glutathione [12-14], contributes to the regeneration of tocopherol, reacting with the radical form [15-16], and a whole series of other circumstances reported in my previous manuscript [17].
——————————————
Figura 1 – Struttura dell’acido L-Ascorbico – By Yikrazuul – Own work, Public Domain, https://commons.wikimedia.org/w/index.php?curid=5886009
Figura 2 – Le fasi finali della biosintesi dell’acido ascorbico ( 3b ) dall’acido gulonico: l’acido L-gulonico ( 1 ) viene convertito in L-gulonolattone (L-gulono-1,4-lattone) ( 2 ) sotto l’influenza catalitica di un glucono-lattonasi ( A ) . Nell’ultima fase, L-gulonolactone ossidasi ( B ) catalizza l’ossidazione selettiva di L-gulonolactone a 2-cheto-L-gulone lattone ( 3a ), che spontaneamente tautomerizza in acido ascorbico ( 3b ) . Il perossido di idrogeno (H 2 O 2 ) viene prodotto come sottoprodotto dell’ossidazione – Von Yikrazuul – Eigenes Werk, Gemeinfrei, https://commons.wikimedia.org/w/index.php?curid=6238581
Figura 3 – La sintesi industriale storica, dell’acido ascorbico partendo dal glucosio attraverso il processo di Reichstein .By Yikrazuul – Own work, Public Domain, https://commons.wikimedia.org/w/index.php?curid=4951563
Figura 4 – Forme canoniche in risonanza dell’anione ascorbato che lo rendono relativamente stabile – By User: Petergans, CC BY-SA 3.0, https://commons.wikimedia.org/w/index.php?curid=28932753;
Figura 5 – Addotto 1-3 dichetonico – CC BY-SA 3.0, https://commons.wikimedia.org/w/index.php?curid=579617
Figura 6 – Radicale semiidroascorbico – By NEUROtiker – Own work, Public Domain, https://commons.wikimedia.org/w/index.php?curid=2332468
Figura 7 – Acido deidroascorbico – By Stanislaw Gackowski – Own work, Public Domain, https://commons.wikimedia.org/w/index.php?curid=8808961
—————————————
[1] https://de.wikipedia.org/wiki/L-Gulonolactonoxidase
[2] https://www.genome.jp/kegg-bin/show_pathway?ko00053+K00225
[3]] La storia naturale dell’acido ascorbico (Vit C) nell’evoluzione dei Mammiferi e dei Primati e suo significato per l’uomo contemporaneo – https://www.dionidream.com/la-storia-naturale-dellacido-ascorbico-vit-c-nellevoluzione-dei-mammiferi-e-dei-primati-e-suo-significato-per-luomo-contemporaneo/
[4] Kawai T, Nishikimi M, Ozawa T, Yagi K. A missense mutation of L-gulono-gamma-lactone oxidase
causes the inability of scurvy-prone osteogenic disorder rats to synthesize L-ascorbic acid. J Biol
Chem. 1992;267(30):21973-21976.
[5] How humans make up for an ‘inborn’ vitamin C deficiency – PUBLIC RELEASE: 20-MAR-2008 –
https://www.eurekalert.org/pub_releases/2008-03/cp-hhm031408.php.
[6] Sage JM, Carruthers A. Human erythrocytes transport dehydroascorbic acid and sugars using the
same transporter complex. Am J Physiol Cell Physiol. 2014;306(10):C910-C917.
doi:10.1152/ajpcell.00044.2014.
[7] Wittko Francke und Wolfgang Walter: Lehrbuch der Organischen Chemie. S. Hirzel Verlag Stuttgart; 24. überarb Auflage 2004, ISBN 3-7776-1221-9; S. 480;
[8] Reichstein, T. und Grüssner, A. (1934): Eine ergiebige Synthese der L-Ascorbinsäure (C-Vitamin), Helv. Chim. Acta 17, S. 311–328;
[9] Brönnimann, C. et al. (1994): Direct oxidation of L-sorbose to 2-Keto-L-gulonic acid with molecular oxygen on Platinum- and Palladium-based catalysts. In: J. Catal. 150(1), S. 199–211; doi: 10.1006/jcat.1994;
[10] Boudrant, J. (1990): Microbial processes for ascorbic acid biosynthesis: a review. In: Enzyme Microb Technol. 12(5); 322–9; PMID 1366548; doi:10.1016/0141-0229(90)90159-N
[11] Bremus, C. et al. (2006): The use of microorganisms in L-ascorbic acid production. In: J Biotechnol. 124(1); 196–205; PMID 16516325; doi:10.1016/j.jbiotec.2006.01.010
[12] Winkler BS, Orselli SM, Rex TS. The redox couple between glutathione and ascorbic acid: a chemical and physiological perspective. Free Radic Biol Med. 1994;17(4):333-349. doi: 10.1016/0891-5849(94)90019-1;
[13] Winkler BS. Unequivocal evidence in support of the nonenzymatic redox coupling between glutathione/glutathione disulfide and ascorbic acid/dehydroascorbic acid. Biochim Biophys Acta. 1992;1117(3):287-290. doi: 10.1016/0304-4165(92)90026-q;
[14] James M. May, Zhi-Chao Qu, Richard R. Whitesell, Charles E. Cobb,
Ascorbate recycling in human erythrocytes: Role of GSH in reducing dehydroascorbate,
Free Radical Biology and Medicine, Volume 20, Issue 4,1996, Pages 543-551,ISSN 0891-5849,
https://doi.org/10.1016/0891-5849(95)02130-2
[15] Pamela Torres, Adinarayana Kunamneni, Antonio Ballesteros, Francisco J. Plou – Enzymatic Modification for Ascorbic Acid and Alpha-Tocopherol to Enhance their Stability in Food and Nutritional Applications – The Open Food Science Journal, 2008, 2: 1-9;
[16] A C Chan, K Tran, T Raynor, P R Ganz and C K Chow. Regeneration of vitamin E in human platelets. September 15, 1991- The Journal of Biological Chemistry 266, 17290-17295.
[17] https://www.cir.cloud/2020/04/04/i-virus-e-possibile-trattamento-di-patologie/
——————-
autore: Riccardo ZANABONI – Centro Italiano Ricerche (C.I.R.) – Roma
(Esponente dello Comitato Scientifico del C.I.R.)
e-mail autore: riccardo.zanaboni@gmail.com
PhD Riccardo Dr ZANABONI
