Experimenta et Hypotheses Chemica: “Il Manganese”

FIGURA 1: Aqueous solution of KMnO4 illustrating the deep purple of Mn(VII) as it occurs in permanganate.
By David Mülheims (David Mülheims, Germany) – Self-photographed, CC BY-SA 2.5, https://commons.wikimedia.org/w/index.php?curid=1254767.
Il Manganese è un elemento chimico con simbolo Mn, numero atomico 25 e configurazione elettronica [Ar]4s2 3d5. Fu scoperto nel 1774 dal chimico svedese Johan Gottlieb Gahn ma i suoi composti entrarono nella storia della chimica molti secoli prima; infatti gli spartani costruivano spade in lega ferro – manganese aventi caratteristiche meccaniche molto efficaci. Gli antichi egizi usarono il biossido di manganese quale pigmento, ma il primo ritrovamento di pigmento al manganese risale a circa 17000 anni fa nelle pitture rupestri. Assieme a gli ossidi di Manganese compongono il colore detto terre di Siena. L’alchimista, farmacista e chimico tedesco Johann Rudolph Glauber nel 1659 ottenne per la prima volta il permanganato di potassio.
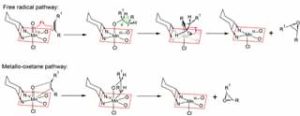
FIGURA 2: Mechanisms of the free-radical and metallo-oxetane pathways of the Jacobsen-Katsuki reaction
By LHcheM – Own work, CC BY-SA 3.0, https://commons.wikimedia.org/w/index.php?curid=38738910
Il Manganese ha stati di ossidazione +2, +3,+4,+6,+7 . Nella crosta terrestre il manganese rappresenta circa 0.11% e l’unico isotopo naturale è Mn (55). I minerali più comuni sono: pirolusite, todorokite, almarudite, benstonite, ericssonite, filipstadite, psilomelano, romanèchite. Il permanganato di potassio è utilizzato per trattamenti farmacologici in caso di tinea pedis, impetigine, pemfigo etc. In chimica analitica il permanganato di potassio in ambiente acido è utilizzato in permanganometria [figura 1]. In chimica organica complessi di Mn (III) è usato come catalizzatore nella sintesi di Jacobsen o nella variante di Jacobsen-Katsuki [figura 2]. In questa reazione enentioselettiva un alchene si trasforma in epossido.
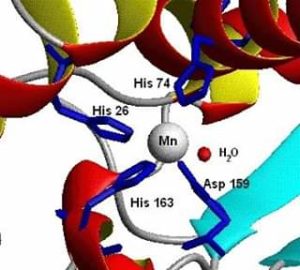
FIGURA 3 : Struttura del sito attivo della superossido dismutasi 2 umana
Di Federico Cisnetti – Opera propria, Pubblico dominio, https://commons.wikimedia.org/w/index.php?curid=1413321
In biochimica Mn (II) risulta essere cofattore di alcuni enzimi; la superossido dismutasi umana, ossidoriduttasi [EC 1.15.1.1] è presente in tre forme diverse: SOD1, SOD2 [figura 3] e SOD3 e catalizza la reazione tra l’anione superossido e lo trasforma in ossigeno e acqua ossigenata.
Manganese
Manganese is a chemical element with the symbol Mn, atomic number 25 and electronic configuration [Ar] 4s2 3d5. It was discovered in 1774 by the Swedish chemist Johan Gottlieb Gahn but its compounds entered the history of chemistry many centuries before; in fact the Spartans built swords in iron-manganese alloy having very effective mechanical characteristics. The ancient Egyptians used manganese dioxide as a pigment, but the first discovery of manganese pigment dates back to about 17000 years ago in cave paintings. The oxides of Manganese form, together others oxides make up the color called lands of Siena. In 1659 the German alchemist, pharmacist and chemist Johann Rudolph Glauber obtained potassium permanganate for the first time. Manganese has oxidation states +2, + 3, + 4, + 6, + 7. In the earth’s crust manganese represents about 0.11% and the only natural isotope is Mn (55). The most common minerals are: pyrolusite, todorokite, almarudite, benstonite, ericssonite, filipstadite, psilomelan, romanèchite. Potassium permanganate is used for pharmacological treatments in the case of tinea pedis, impetigo, pemphigus etc. In analytical chemistry the potassium permanganate in an acid environment is used in permanganometry [figure 1]. In organic chemistry, Mn (III) complexes are used as a catalyst in the synthesis of Jacobsen or in the Jacobsen-Katsuki variant [figure 2]. In this enentioselective reaction an alkene is transformed into an epoxide. In biochemistry Mn (II) turns out to be a cofactor of some enzymes; human superoxide dismutase, oxidoreductase [EC 1.15.1.1] is present in three different forms: SOD1, SOD2 [figure 3] and SOD3 and catalyzes the reaction between the superoxide anion and transforms it into oxygen and hydrogen peroxide.
A cura del Dr. Riccardo Zanaboni (Esponente del Comitato Scientifico del Centro Italiano Ricerche)
By: C.I.R. Centro Italiano Ricerche
Fonti:
1) https://it.wikipedia.org/wiki/Manganese;
2) https://it.wikipedia.org/wiki/Epossidazione_di_Jacobsen;
3) https://it.wikipedia.org/wiki/Superossido_dismutasi;
4)http://periodictable.com/Elements/025/data.html;
5)Zhang, W.; Loebach, J. L.; Wilson, S. R.; Jacobsen, E. N. (March 1990). “Enantioselective epoxidation of unfunctionalized olefins catalyzed by salen manganese complexes”. Journal of the American Chemical Society. 112 (7): 2801–2803. doi:10.1021/ja00163a052;
6)Jacobsen Epoxidation”. Organic Chemistry Portal. Retrieved 2009-09-22.
7)Linker, T. (1997). “Jacobsen-Katsuki epoxidation and its controversial mechanism”. Angew. Chem. Int. Ed. Engl. 36: 2060–2062. doi:10.1002/anie.199720601
FIGURA 1: Aqueous solution of KMnO4 illustrating the deep purple of Mn(VII) as it occurs in permanganate.
By David Mülheims (David Mülheims, Germany) – Self-photographed, CC BY-SA 2.5, Fonte:
FIGURA 2: Mechanisms of the free-radical and metallo-oxetane pathways of the Jacobsen-Katsuki reaction
By LHcheM – Own work, CC BY-SA 3.0, Fonte:
FIGURA 3 : Struttura del sito attivo della superossido dismutasi 2 umana
Di Federico Cisnetti – Opera propria, Pubblico dominio fonte:
