Acido cianidrico (Experimenta et Hypotheses Chemica)
L’acido cianidrico, a volte chiamato cianuro di idrogeno o acido prussico, ha una formula bruta di HCN. Ha punto di fusione T = 259,86 K = -13,29 ° C e punto di ebollizione T = 299 K = 26 ° C. È miscelato sia in etanolo che in acqua dove è possibile misurare a 25 ° C Ka= 4*10^-10 e pKa = 9,21 e quindi la molecola indissociata sarà molto abbondante rispetto all’anione cianidrico che invece è predominante e stabilizzato a un pH fortemente alcalino. Il cianuro è un legante molto efficace e tende a ossidarsi a cianogeno in presenza di alcuni ioni metallici di transizione ( Ag(I), Cu(II), Hg(II),….,) [Figura 1-4]. Una forma tautomerica dell’acido cianidrico è l’acido isocianidrico [Figura 1-3].

FIGURA 1 1-1 Andressow Process 1-2 BMA process o Degussa; 1-3 tautomeria acido cianidrico – acido isocianidrico; 1-4 Reazione redox di formazione del cianogeno dal cianuro.
L’acido cianidrico fu per la prima volta ottenuto dal pigmento blu di Prussia [Fig 2]. Successivamente sono stati scoperti e perfezionati due metodi per sintetizzare acido cianidrico. Parliamo del processo di Andressow e processo BMA o Degussa.Il Processo di Andressow viene condotto facendo reagire metano con ammoniaca in presenza di aria [Fig 1-1] con formazione di acido cianidrico e acqua. Questa reazione è fortemente esotermica con ?H= – 481,06 KJ/mol. Il processo BMA o Degussa viene condotto facendo reagire metano e ammoniaca in assenza di aria e pertanto si profila la reazione [Fig1-2], reazione fortemente endotermica con ?H= + 251KJ/mol. Per ambedue i processi industriali viene utilizzato un catalizzatore di platino.

FIGURA 2 2-1 Figura 2-1 -Pittura ad olio blu di Prussia diluita con trementina….
Storicamente l’acido cianidrico ha avuto impieghi bellici, usato come gas chimico mescolato con il cloruro di cianogeno [2-4] soprattutto nel primo conflitto mondiale. Nella seconda guerra mondiale i nazisti hanno impiegato anche il cianuro per sterminare prigionieri ebrei nei campi di concentramento. Storicamente il cianuro è stato utilizzato per estrarre argento e oro. In natura troviamo derivati organici dei cianuri ovvero amigladine e mandelonitrili molecole contenute nei noccioli di ciliegie, albicocche, pesche, mele ecc. alcune specie di millepiedi rilasciano acido cianidrico quale meccanismo di difesa. dal punto di vista tossicologico, il cianuro e derivati sono tra le molecole più pericolose e tossiche, infatti pochi milligrammi sono in grado di uccidere un individuo adulto in pochi minuti inibendo l’enzima citocromo c ossidasi e bloccando la respirazione cellulare.
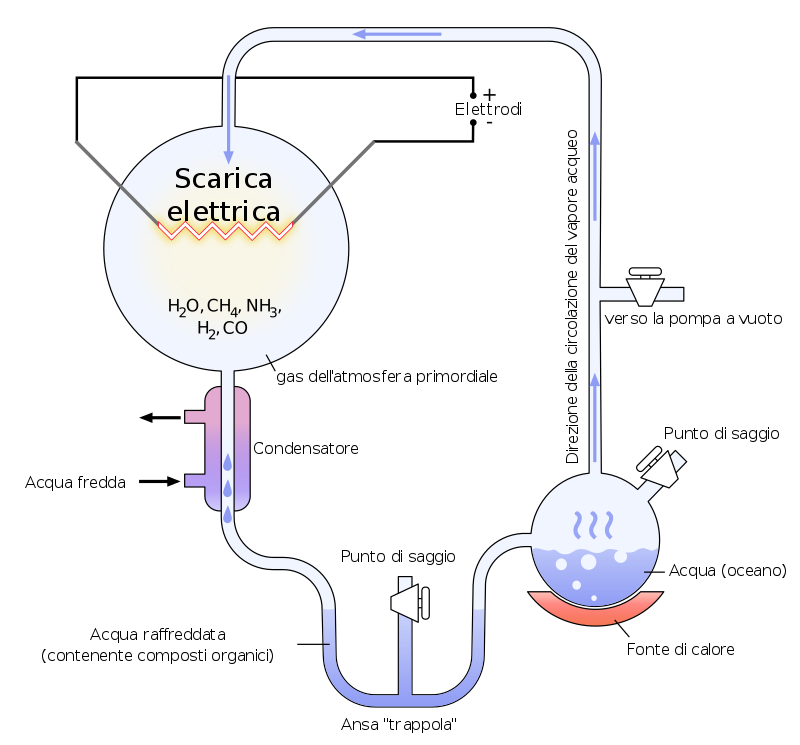
FIGURA 3 Schema dell’esperimento di Miller- Urey senza acido cianidrico….
L’ acido cianidrico sembra essere presente in mezzi interstellari e in atmosfere di stelle al carbonio. L’acido cianidrico è stato rilevato dalla sonda “Cassini” nell’atmosfera di Titano, satellite di Saturno. Probabilmente l’acido cianidrico era presente nell’atmosfera primordiale terrestre, infatti dopo l’esperimento di Miller-Urey dove sottoposero in un ambiente chiuso metano, anidride carbonica, azoto, ammoniaca a scariche elettriche ottennero molti aminoacidi proteici e non proteici ma non basi azotate del DNA; se nell’ambiente di reazione poniamo anche acido cianidrico si forma l’Adenina, risultato conseguito dal biochimico spagnolo Joan Oro’ i Florenza nel 1961. In Figura 1 – 3 c è un errore nella rappresentazione dell’ acido isocianidrico, l idrogeno è legato all’azoto.
Hydrocyanic acid
Hydrocyanic acid, sometimes called hydrogen cyanide or prussic acid, has a brute formula HCN. It has a melting point T = 259.86 K = -13.29 ° C and boiling point T = 299 K = 26 ° C. It is mixed both in ethanol and in water where it is possible to measure at 25 ° C Ka = 4 * 10 ^ -10 and pKa = 9.21 and therefore the indissociated molecule will be very abundant compared to the cyanid anion which instead is predominant and stabilized at a strongly alkaline pH. Cyanide is a very effective binder and tends to oxidize to cyanogen in the presence of some transition metal ions (Ag (I), Cu (II), Hg (II), ….,) [Figure 1-4]. A tautomeric form of hydrocyanic acid is isocyanidric acid [Figure 1-3].
Hydrocyanic acid was first obtained from the blue Prussian pigment [Fig 2]. Subsequently two methods to synthesize hydrocyanic acid were discovered and perfected. Let’s talk about the Andressow process and the BMA or Degussa process. The Andressow Process is conducted by reacting methane with ammonia in the presence of air [Fig 1-1] with formation of hydrocyanic acid and water. This reaction is strongly exothermic with ?H = – 481.06 KJ / mol. The BMA or Degussa process is carried out by reacting methane and ammonia in the absence of air and therefore the reaction [Fig1-2], a strongly endothermic reaction with ?H = + 251KJ / mol is profiled. A platinum catalyst is used for both industrial processes. Historically, hydrocyanic acid has been used for military purposes, used as a chemical gas mixed with cyanogen chloride [2-4] especially in the First World War. In the Second World War the Nazis also employed cyanide to exterminate Jewish prisoners in concentration camps. Historically, cyanide has been used to extract silver and gold. In nature we find organic derivatives of cyanides or amygladines and mandelonitriles molecules contained in the kernels of cherries, apricots, peaches, apples, etc. some species of millipedes release hydrocyanic acid as a defense mechanism. from a toxicological point of view, cyanide and derivatives are among the most dangerous and toxic molecules, in fact a few milligrams are able to kill an adult individual in a few minutes by inhibiting the cytochrome c oxidase enzyme and blocking cell respiration.
Hydrocyanic acid appears to be present in interstellar media and in carbon-star atmospheres. Hydrocyanic acid was detected by the “Cassini” probe in the atmosphere of Titan, Saturn’s satellite. Probably the hydrocyanic acid was present in the earth’s primordial atmosphere, in fact after the Miller-Urey experiment where they subjected methane, carbon dioxide, nitrogen, ammonia to electric discharges in a closed environment, they obtained many protein and non-protein amino acids but not nitrogenous bases of DNA; if we also place hydrogen cyanide in the reaction environment Adenine is formed, a result obtained by the Spanish biochemist Joan Oro ‘i Florenza in 1961. In Figure 1-3 you can see a wrong in isocyanidric acid formula.
FIGURA 1: 1-1: Andressow Process: 1-2: BMA process o Degussa; 1-3 tautomeria acido cianidrico – acido isocianidrico (errato in questa rappresentazione; 1-4: Reazione redox di formazione del cianogeno dal cianuro.
FIGURA 2: 2-1: Figura 2-1 -Pittura ad olio blu di Prussia diluita con trementina. -De Picture created by publunch – image was taken from En-Wiki: en:Image:Prussian blue.jpg, Dominio público, – 2-2: Struttura dell’anione esacianoferroso – Von IlgomDerivative work: Muskid – Abwandlung von HexacyanidoferratIII.svg, Gemeinfrei, https://commons.wikimedia.org/w/index.php?curid=21981111; 2-3: Formule di 2 composti del blu di prussia, 1) solubile in acqua, 2) Insolubile in acqua; 2-4: Reazione di Formazione del cloruro di cianogeno.
FIGURA 3: Schema dell’esperimento di Miller- Urey senza acido cianidrico. Di HeNRyKus – Miller-Urey experiment-en.svg on Commons, CC BY-SA 3.0, https://commons.wikimedia.org/w/index.php?curid=54930800
Fonti:
a)https://en.wikipedia.org/wiki/Hydrogen_cyanide;
b) https://es.wikipedia.org/wiki/Azul_de_Prusia;
c)https://de.wikipedia.org/wiki/Andrussow-Verfahren;
d)https://en.wikipedia.org/wiki/BMA_process;
e)https://it.wikipedia.org/wiki/Esperimento_di_Miller-Urey
f)A Production of Amino Acids Under Possible Primitive Earth Conditions – Stanley L. Miller – Science 15 May 1953:
Vol. 117, Issue 3046, pp. 528-529
DOI: 10.1126/science.117.3046.528
g)Pearce, Ben K. D.; Ayers, Paul W.; Pudritz, Ralph E. (2019-02-20). “A Consistent Reduced Network for HCN Chemistry in Early Earth and Titan Atmospheres: Quantum Calculations of Reaction Rate Coefficients”. The Journal of Physical Chemistry A. 123 (9): 1861–1873. arXiv:1902.05574. Bibcode:2019JPCA..123.1861P. doi:10.1021/acs.jpca.8b11323. ISSN 1089-5639. PMID 30721064;
h)Wade, Nicholas (2015-05-04). “Making Sense of the Chemistry That Led to Life on Earth”. The New York Times. Retrieved 5 May 2015.
i)https://de.wikipedia.org/wiki/Chlorcyan
Fonte articolo:
Dr Riccardo Zanaboni
Esponente del Comitato Scientifico del Centro Italiano Ricerche
By C.I.R.
